莫德纳疫苗预防新冠94.5%有效,还可预防重症
11月16日晚,新冠疫苗又有大消息!
继上周一辉瑞宣布疫苗“有效性超90%”后,当地时间周一(16日),Moderna宣布其研制的新冠疫苗在冰箱温度下可维持稳定30天,且不需要现场稀释,三期试验疫苗有效性为94.5%,新冠疫苗总体上是安全的,耐受性良好,副作用包括疲劳、肌肉和关节疼痛和头痛。
Moderna公司已经准备好了数百万剂的新冠疫苗,计划在未来几周内向美国申请新冠疫苗的紧急使用权,等待美国食品药品监督管理局(FDA)批准。
1. 94.5%保护率
2. 预防重症:疫苗保护失败的接种者,感染病毒之后,只是出现了轻症
3. 存储、运输相对方便:只需要负20摄氏度,而之前辉瑞的疫苗需要 负70摄氏度
继辉瑞公司宣布他们的疫苗对预防新冠肺炎(COVID-19)90%有效之后,美国东部时间11.16(周一)早晨,莫德纳公司也在其官网宣布其疫苗有效率达94.5%。同时也公开了一些有效性分析的细节。
辉瑞和莫德纳mRNA疫苗的常识。
疫苗的作用是通过注射病毒或细菌的一些独有的成分,训练人体的免疫系统对这种病毒或细菌产生免疫反应。当真正的病毒或细菌入侵人体时,就会被迅速清除,使得这些病原体无法在体内分裂和增殖,不会感染人体的组织器官,也就不会产生症状,更不会成为传染源,于是彻底阻断病毒或细菌的感染和传播。
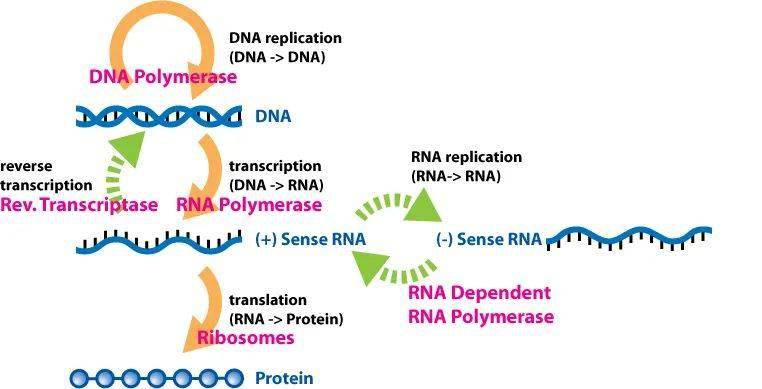
以往的疫苗是选取病原体的一部分蛋白质,也叫抗原。而蛋白质是以DNA上的一段基因为模板制造的。DNA是两条链,平时互补结合在一起。当需要制造蛋白质时,DNA模板上这一段会临时打开,抄写成一小段RNA,这一小段RNA就叫做信使RNA(mRNA)。合成蛋白质的原料是氨基酸,不同的氨基酸排列形成不同的蛋白质。而需要哪些氨基酸,怎样排列,就按照mRNA上抄写的DNA模板来组装。
人体蛋白质合成的中心法则(图片来源于网络)
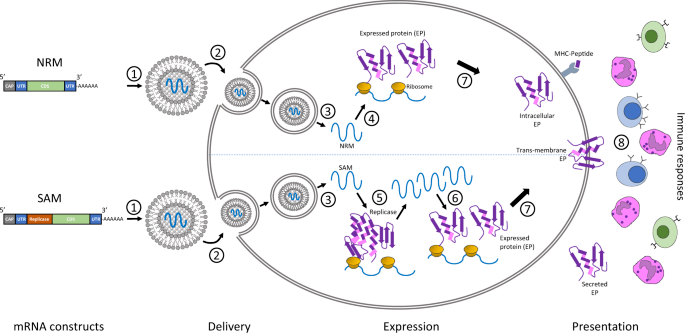
人体里面并没有编码新冠病毒蛋白质的模板,要制造新的蛋白质,可以将病毒DNA整合进人体细胞,有些病毒就是这样感染人体的,比如乙肝病毒。也可以直接注入可以制造蛋白质的mRNA。新冠病毒mRNA疫苗就是将编码蛋白质的mRNA注射入人体,mRNA进入人体细胞后,就可以借助细胞的核糖体制作相应的蛋白质,也就是抗原,后面的反应就和传统的疫苗一样了。
mRNA疫苗原理示意图(图片来源于网络)
mRNA疫苗相比传统疫苗的最大好处是,一旦成功生产效率远高过传统疫苗。两者的区别大概类似于生产模型和实物的差别。
那么莫德纳疫苗94.5%有效率的结论是怎么来的?
首先,这个结论不是莫德纳自己得出的。因为利益关系,药物和疫苗的有效性必须要由权威的第三方设计试验,并追踪和报道数据。
莫德纳疫苗的临床试验是在美国国立卫生院(NIH)委托的一个数据安全监测委员会(DSMB)实施并监测,所使用的疫苗是编码新冠病毒针刺蛋白的mRNA,暂定命名为mRNA-1273,这次试验是它的3期临床试验,也是疫苗临床试验中最重要,变数最多,也最耗时的一步。
根据对疫苗有效性的要求,感染率等参数,试验的设定人数是3万人,按照1:1的比例随机注射疫苗和生理盐水。目前94.5%的有效率,根据的是对试验人群的感染情况。所有试验参与者中,共有95人被感染。其中对照组90人,疫苗组5人。如果全部都注射疫苗的话,那么理论上来说,对照组90个感染者中的85人就不会被感染,94.5%的有效率大致是85/90得出来的。
此外,在对照组90个被感染的病人中,有12人属于重症,而5个接种疫苗的感染者中没有一个重症,提示疫苗不仅可以预防感染,还可能防止感染者向重症转化。
参与者的录入标准也是经过了精心设计,既要有代表性,又要突出高危人群,其中包括7000名65岁以上的老人,5000名65岁以下但有新冠肺炎高危因素的人,包括糖尿病、肥胖、高血压等等,这一部分人占总参与者的42%。另外,考虑到前期美国少数族裔社区是新冠重灾区,因此37%的试验对象来自这些社区,其中西裔和拉丁裔6000人,黑人或非裔3000人。而以往这些少数群体是经常被临床试验所忽视。
疫苗安全性如何?
进入3期临床试验的疫苗和药物,大多已经在2期临床试验中经过了初步的安全评估,证明对人体没有明显的伤害。3期临床试验则可以进一步观察一些小概率的不良反应。目前的观察,莫德纳的疫苗和辉瑞疫苗的安全性都很好,不良反应都在可接受的范围之内。
莫德纳疫苗的第一剂不良反应只有2.7%,为注射部位疼痛,第二剂不良反应为乏力(9.7%),肌肉疼痛(8.9%),关节痛(5.2%),头痛(4.5%),注射部位疼痛(4.1%)和红肿(2.0%)。需要给予医疗处理3级不良反应的只有2%。
生产情况
莫德纳已经向美国食品药品管理局(FDA)和其他国家的药物监管部门提交了紧急使用授权(EUA),和其他类似的使用授权。获批后,莫德纳宣布现有两千万剂可以直接投放,2021年的生产能力可以达到5亿到10亿剂。
莫德纳疫苗研发路径回顾
2020.02.07
关于新冠mRNA的首个实验结束并进行分析
2020.03.16
首个mRNA-1273临床试验1期志愿者接受注射
2020.05.12
FDA批准mRNA-1273快速设计
2020.05.29
2期临床试验首位参与者接种
2020.07.08
2期临床试验参与者招募截止
2020.07.14
1期临床试验第一个中期分析发表
2020.07.28
mRNA-1273非人类灵长类动物实验结果发表
2020.09.29
1期临床试验第二个中期分析发表
2020.10.22
3期临床试验COVE研究宣布完成30000名参与者招募
2020.11.16
3期临床试验COVE首个中期分析显示疫苗有效率94.5%